Offre de services
PG Consulting vous accompagne dans le développement de vos candidats-produits,
de la phase de discovery à l’initiation de la phase clinique
Fondateur du cabinet PG Consulting, basé à Strasbourg et Antibes, je propose des solutions d’accompagnement personnalisées et adaptées à vos projets. Au travers de ma double compétence (PhD et PharmD) et de mon expérience, mon objectif est de vous assister dans les différentes étapes de la partie R&D et de vous apporter une meilleure compréhension scientifique, industrielle et réglementaire en particulier dans le monde complexe de l’industrie pharmaceutique et de la biotech.
Réactif et flexible, j’interviens à distance ou sur site, en prestation de services ou à temps partiel, selon les besoins.
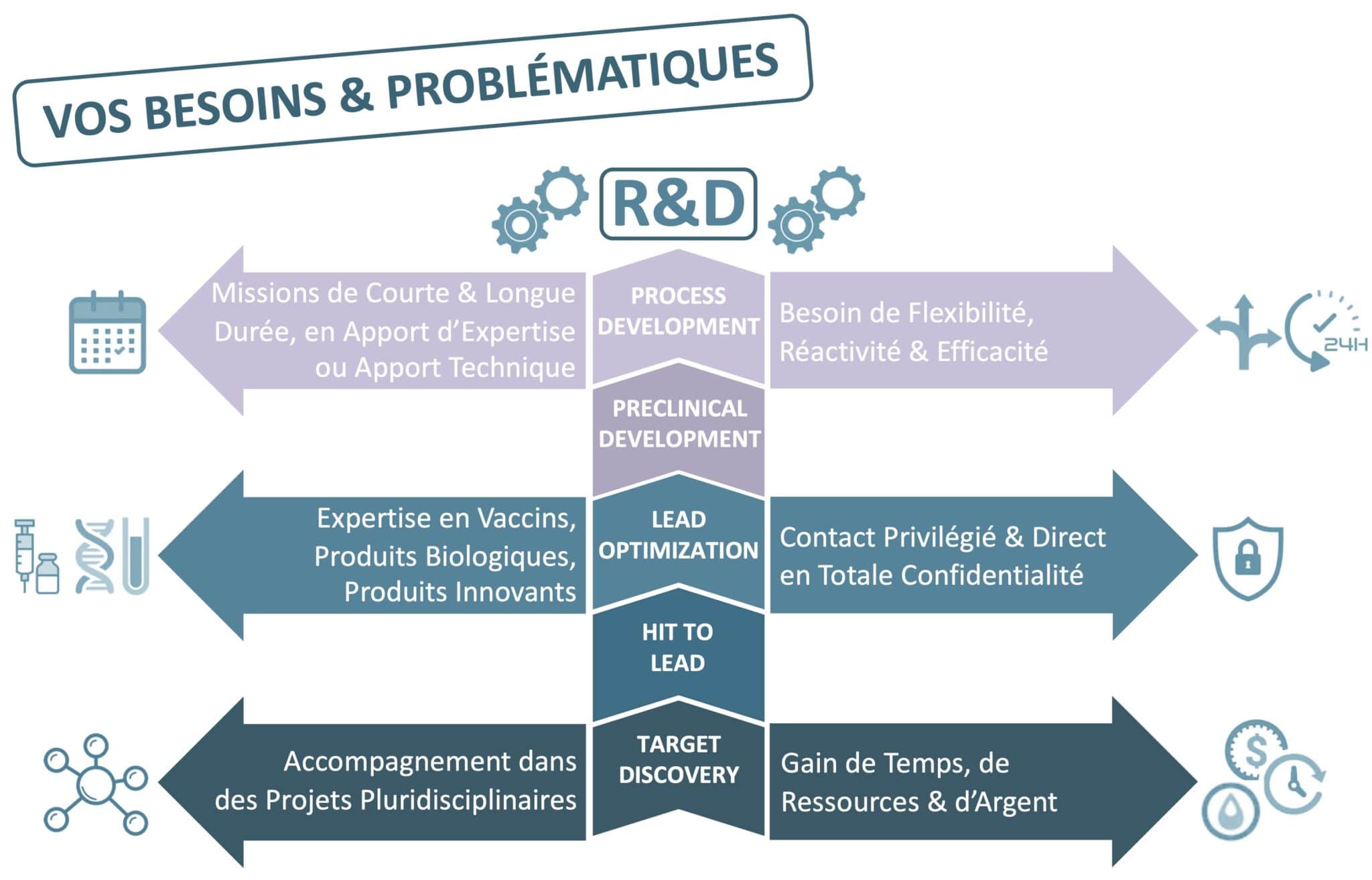
Aires thérapeutiques et spécialités ciblées:
• Domaines principaux : Vaccins, Inflammation/Immunologie, Oncologie, Maladies infectieuses,
• Domaines complémentaires : maladies rares, homéopathie (nosodes), cosmétiques (produits d’hygiène, de maquillage, soins pour la peau, produits solaires), dispositifs médicaux (sprays nasaux, traitements de la constipation chronique, pansements/soins des plaies, implants orthopédiques et traumatologiques, orthèses, cathéters), compléments alimentaires…
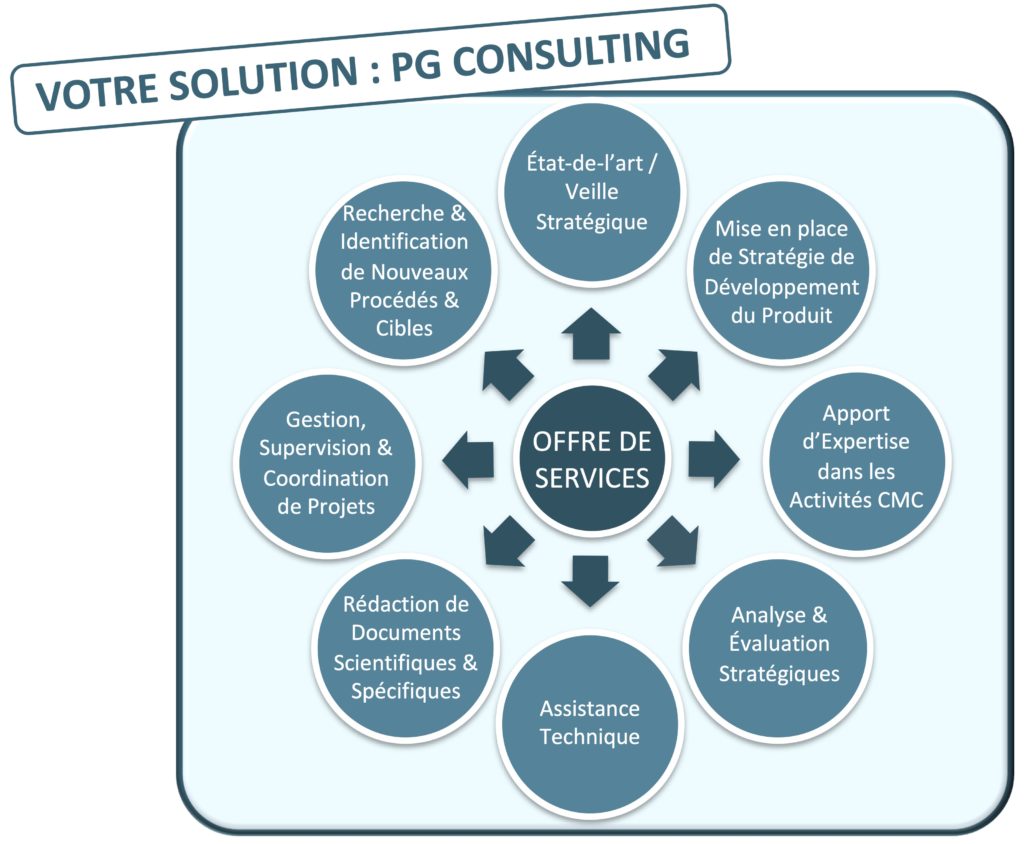
État de l’art

– Réalisation d’un état de l’art scientifique ou technologique
À travers une étude ciblée, approfondie et critique constructive (avantages, inconvénients, verrous scientifiques et technologiques) des travaux de recherche (articles, brevets, projets R&D…) publiés et réalisés sur un thème particulier, l’état de l’art est une étape fondamentale et indispensable de votre programme ou de votre projet de R&D.
L’état de l’art doit permettre de :
• Valider l’orientation de votre projet R&D ;
• Participer à la recherche d’antériorité en vue d’un dépôt de brevet (nouveau marché ciblé, nouveau produit développé…) ;
• Avoir une vision globale des technologies ayant donné lieu à des dépôts de publications scientifiques ou de brevets ;
• Détecter des technologies émergentes ;
• Trouver une solution face à un verrou technologique / trouver de nouvelles pistes alternatives ;
• Identifier des partenaires potentiels ou concurrents et évaluer leur positionnement.
– Outre la réalisation d’un état de l’art, PG Consulting vous propose également la mise en place et la réalisation de Veille Stratégique (veilles scientifique, technologique, réglementaire, concurrentielle et commerciale), après avoir préalablement défini les axes de veille prioritaires selon vos besoins et objectifs. La veille stratégique est un processus de recherche, d’analyse, de traitement et de diffusion de l’information. Elle aide et permet la prise de décision stratégique pour l’entreprise. Elle reflète ainsi une importance stratégique pour l’entreprise en agissant comme un véritable moteur de développement.
La veille participe à des points fondamentaux comme :
• La connaissance de l’environnement de l’entreprise de façon générale ;
• La surveillance et la facilitation de la gestion de crises potentielles ;
• L’évaluation de la position compétitive actuelle et future de la société face à ses concurrents avec une perspective des actions potentielles à mener ;
• La connaissance de l’évolution du marché, de l’innovation ;
• La détection d’opportunités de développement ou de technologies émergentes dans votre domaine ;
• L’anticipation des risques et la détection de menaces éventuelles ;
• L’amélioration, le développement et l’élargissement de l’ensemble des activités de la société via le développement de technologies innovantes, de nouveau positionnement R&D ou la recherche de nouveaux partenaires potentiels et marchés ;
• La pérennisation de la présence de l’entreprise et de ses activités ;
• L’identification et l’anticipation des nouvelles exigences réglementaires ;
• L’optimisation du processus de prise de décision stratégique.


– Rédaction de documents scientifiques & spécifiques aux secteurs des Life Sciences
• Dossiers techniques du CIR (crédit d’impôt recherche) ;
• Réalisations d’état de l’art ;
• Rapports d’étude ;
• Diaporamas pour des présentations orales ;
• Gap analysis ;
• Révisions scientifiques ;
• Publications dans des revues scientifiques à comité de lecture ;
• Propositions de projet de recherche/workplan ;
• Dossiers de candidature à un appel à projets ;
• Programmes de maturation ;
• Protocoles ;
• …

– Mise en place de stratégie de développement de votre candidat-produit
PG Consulting vous guide à travers les nombreuses étapes et différents aspects de la stratégie du développement de votre candidat comme :
• Soutien dans les phases de Discovery : Target identification & Validation, Screening & Hit identification, Hit-to-Lead (H2L, Lead generation), Lead optimization ;
• Recherche et identification de nouveaux produits, cibles, procédés ou pistes d’innovation : Ce sont des étapes fondamentales qui vont favoriser la réussite de vos projets ;
• Identification des besoins médicaux non satisfaits ;
• Étude de faisabilité, analyse du marché, positionnement technologique et analyse de l’environnement concurrentiel.
Afin de vérifier que le projet est techniquement réalisable et économiquement rentable et ainsi qu’il mérite d’être amorcé, nous proposons de vous accompagner dans la réalisation d’une étude de faisabilité de votre projet sur les volets technologiques, économiques et financiers, opérationnels et organisationnels, juridiques et réglementaires et commerciaux ;
Réalisation possible d’une étude de marché personnalisée, indispensable notamment à la cohérence et pertinence commerciale de votre projet, à l’amélioration de la connaissance du marché ciblé et à l’établissement d’un prévisionnel financier.
L’analyse du positionnement technologique permet à l’entreprise de comprendre pleinement son positionnement sur le marché, d’identifier les faiblesses et difficultés potentielles ou voies de développement à prioriser et de pouvoir anticiper la mise en place de mesures et actions afin de saisir des opportunités ou de contrer des menaces éventuelles identifiées ;
• Définition du Target Product Profile (TPP) en prenant en compte les contraintes réglementaires. Le TPP est un outil stratégique dans le développement de votre candidat. Il résume les caractéristiques nécessaires d’un produit commercial envisagé visant une ou plusieurs maladies particulières et il fournit une base pour conduire une planification efficace du programme de développement de votre candidat.
+ Identification des éléments clés du Quality-by-Design (QbD) pharmaceutique : QTPP, CQA, CMA, CPP ;
• Élaboration de plan de développement personnalisé de votre candidat et conforme à la réglementation, avec échéanciers, budget et évaluation des risques ;
• Appui au développement du programme CMC (conseils et reviews) ;
• Appui au développement du programme non-clinique (conseils et reviews) ;
• Participation dans l’orientation des projets de développement clinique pour les nouveaux produits ;
• Réalisation d’une analyse des écarts (gap analysis) de l’ensemble des données CMC, non-cliniques et de toutes autres données et informations disponibles sur le produit ;
• Recommandations et propositions d’actions à mettre en place afin de répondre à des évolutions réglementaires ;
• Support technique, technique et réglementaire durant le développement de votre produit afin de remplir les exigences d’une future autorisation de mise sur le marché (AMM) ;
• Collaboration possible avec d’autres cabinets partenaires afin de compléter votre développement.

– Analyse & évaluation stratégiques de vos projets R&D
Conseils & reviews en lien avec votre plan de développement, des protocoles opératoires, des résultats et données expérimentaux, des méthodes ou procédés à implémenter, voire la soumission de rapports/dossiers afin d’augmenter la valeur de votre projet et de favoriser sa réussite.
À différents stades de développement de votre projet R&D, nous vous proposons une review de celui-ci à travers notamment la méthode « gap analysis » afin d’identifier des écarts/lacunes et d’apporter des recommandations et propositions d’actions (ou plans d’action) à mettre en place.


– Gestion, supervision & coordination de vos projets (e.g., projets innovants, multidisciplinaires et/ou tranverses)
– Pilotage, coordination et suivi du déroulement du projet
• Planification, suivi et contrôle des livrables, du planning, du budget ;
• Participation à la recherche et à la validation de collaborations avec des laboratoires académiques et des prestataires de services (CROs, CDMOs) ;
• Mise en place et réalisation d’une veille technologique, scientifique, réglementaire et concurrentielle liée au projet ;
• Identification et évaluation des risques et problèmes potentiels, puis mise en œuvre des plans d’action correspondants ;
• Pilotage, animation et coordination des acteurs internes et/ou externes du projet ;
• Organisation et réalisation des expériences. Analyse des résultats obtenus ;
• Selon les résultats obtenus, choix de l’orientation des nouvelles expériences.
– Contrôle et finalisation du projet
• Vous assurer des points réguliers : état d’avancement du programme, partage des connaissances, validation des résultats ;
• Vous assurer le reporting final du travail ;
• Identifier les étapes envisagées et/ou les pistes d’amélioration. Réalisation d’un plan d’action post-projet.
– Apport d’expertise dans les activités de développement pharmaceutique CMC (Chemistry, Manufacturing & Controls) de vos produits
La partie Qualité, dite « CMC », du développement pharmaceutique de votre produit regroupe les informations chimiques, pharmaceutiques et biologiques relatives à la substance active pharmaceutique (API) et au produit fini (FPP). Cette partie est fondamentale et doit s’anticiper de manière très précoce. Selon la FDA, les informations sur la CMC constituent d’ailleurs la cause la plus fréquente de suspensions cliniques.
– Appui dans le développement et optimisation de la formulation & du process de votre candidat-produit tout en tenant compte des exigences industrielles et réglementaires ;
– Accompagnement dans l’identification & la gestion/suivi des CROs et CDMOs
• Identification de la stratégie globale de votre société & de vos besoins et préférences & élaboration des critères de sélection du futur partenaire à travers la réalisation d’un cahier des charges ;
• Gestion et supervision des CROs et CDMOs concernant le développement et la validation des méthodes analytiques et du « potency test », le développement de lignées cellulaires, le développement des procédés upstream (USP) et downstream (DSP), le Drug Product (DP) development (développement de formulation, Fill&Finish), les études de stabilité…
– Adaptation aux guidelines internationaux (de l’ICH et des autorités de santé), conformité aux monographies en vigueur & Mise en place du QbD en vue du développement pharmaceutique de votre candidat-produit ainsi que de la rédaction du dossier de demande d’étude clinique (CTA/IND) et du document technique commun (CTD), qui doit s’anticiper dès les premières phases de développement ;
• Justification scientifique et réglementaire (articles scientifiques, rapports d’évaluation de médicaments ou vaccins approuvés par les autorités de santé, monographies de pharmacopées, guidelines…) ;
• Support à la review de certains dossiers d’enregistrement ;
• Anticipation des potentielles questions et demandes des autorités de santé.

– Accompagnement dans le développement & validation des méthodes analytiques. Mise en place des spécifications. Études de stabilité
• Identification et maîtrise des méthodes analytiques et des spécifications afin de s’assurer de la qualité des matières premières de départ de la substance active pharmaceutique, de la substance active pharmaceutique (API) elle-même et des excipients engagés en production et du produit final obtenu ainsi que de la conformité du produit aux réglementations et spécifications en vigueur. De plus, une matière bien caractérisée par ses spécifications minimisera la survenue de problèmes pendant le développement du produit ;
• Appui au développement de « potency test ». Le but de ce test est d’établir ou de vérifier la concentration de la ou des substances pharmaceutiques dans la préparation composée. Le « potency test », conçu pour démontrer la cohérence entre les lots, tout particulièrement dans le cas de produit biologique, est ainsi un composant essentiel du Contrôle Qualité ;
• Accompagnement dans le développement et la réalisation de protocoles d’études de stabilité spécifiques, en conformité avec les standards internationaux ICH.
– Transposition industrielle, Transfert de technologie
• Anticipation & évaluation des risques potentiels du changement d’échelle ;
• Identification des différentes étapes et détermination des points critiques du transfert de technologie ;
• Évaluation de l’adaptation industrielle du produit et des installations de production par rapport à l’environnement et aux exigences réglementaires/recherche de solutions de rechange ;
• Aide à l’implémentation du procédé de production auprès de la CDMO spécialisée dans le Fill&Finish (identification finale du façonnier, rédaction d’un cahier des charges (SoW), Quality agreement, réalisation de lot technique).
– Appui dans le développement et l’optimisation des procédés upstream (USP) & procédés downstream (DSP)
• USP : production de lignée cellulaire (en fonction de la présence de cellules adhérentes ou en suspension, la présence/absence de serum, l’utilisation de microporteurs…), récolte cellulaire. QC associé (viabilité cellulaire, densité cellulaire…) ;
• DSP : principalement les étapes de lyse cellulaire, clarification, chromatographie (capture, purification intermédiaire, polissage), procédé ATPS. QC associé (quantification HCP, HC DNA, endotoxines, autres impuretés résiduelles).


– Assistance technique
• Assistance dans la réalisation de vos expériences en respectant les instructions et protocoles prescrits ;
• Aide dans les analyses et l’interprétation de vos expériences ainsi que dans la rédaction des comptes-rendus correspondants ;
• Proposition de solutions en cas d’anomalies ;
• Réalisation d’un diagnostic et mise en place des actions nécessaires à l’amélioration de vos process de production ;
• Participation au développement de nouvelles méthodes d’analyses et rédaction de documents techniques correspondants (protocole d’analyse…).
Vous avez un projet ou un besoin particulier et vous souhaitez en discuter ? N’hésitez pas à réserver un créneau à votre convenance
